全球癌症负担每年造成近1000万人死亡,预计还会增加。1不幸的是,有效的癌症治疗数量未能跟上这一趋势。其中一个原因是缺乏准确模拟人类肿瘤及其不同形态、分子特征和微环境的体外临床前模型。几十年来,由于其相对易用性、可扩展性和低成本,2D细胞培养一直是研究癌症细胞生物学和药物发现的基石。他们在肿瘤发生的分子机制方面进行了开创性的研究,并帮助确定了指导患者治疗的生物标志物和药物靶点。然而,它们的种类有限,仅代表其中一小部分癌症,很少来自早期或癌前阶段。与原代细胞培养物相比,2D培养物通常也不需要相同的生态位因子来生存,这意味着由于其基因组的畸变和扭曲以及表观基因组的修饰,它们已经失去了对生态位的内在依赖。此外,长期体外培养的2D癌症细胞系会经历快速的基因漂移,从而导致药物反应的显著差异。此外,匹配的正常细胞系并不总是存在的,这使得对癌症早期阶段的研究大多依赖于基因工程小鼠。在某些情况下,基因工程小鼠和患者来源的异种移植物(PDX)模型弥补了2D细胞系的缺点,但高成本、技术难度和缺乏可扩展性仍然是它们的局限性。
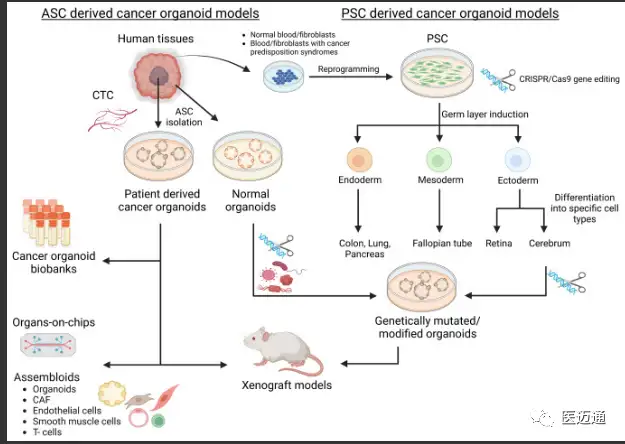
最近,3D类器官培养的出现为癌症研究提供了一种替代方法,可以弥合体外2D细胞系和体内小鼠模型之间的差距。类器官可以从两种类型的干细胞中建立:来自组织特异性成体组织的成体干细胞(ASC),或者可以是诱导多能干细胞(iPSC)或胚胎的多能干细胞。
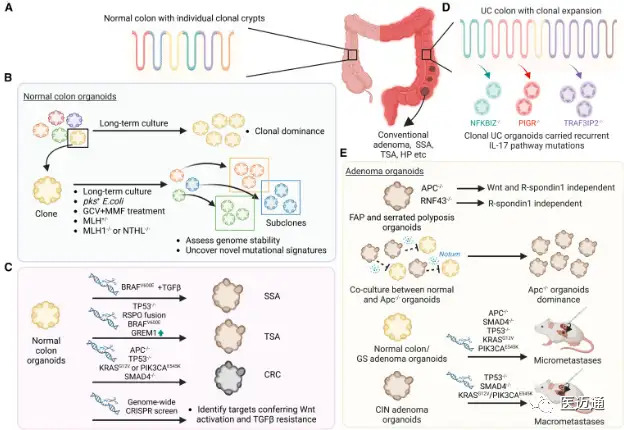
尽管类器官技术彻底改变了癌症研究并具有广泛的潜在应用,但它仍面临技术限制。尽管ASC肿瘤衍生的类器官在基因组上通常是稳定的,但也有一些例外。来源于汇集的肠腺的正常类器官在长期培养中可能趋向克隆优势,影响汇集的正常类脏器用于全基因组CRISPR筛选。类器官也可以在长期培养中获得新的突变,尽管这种突变通常是亚克隆的、随机的,并且主要影响非编码区。具有固有基因组不稳定性的类器官可能更快地获得突变,如一项对微卫星不稳定肿瘤类器官的研究所示。有趣的是,这种固有的不稳定性已经被用来模拟肿瘤进化的早期阶段。有关研究用TP53突变改造的胃类器官中染色体拷贝数的变化,并注意到在2年内进行性非整倍体。即使类器官基因组和突变谱稳定,表型不稳定也可能是生长条件变化造成的。尿路上皮性癌症类器官的一个亚群在母代肿瘤中显示出管腔亚型,尽管亚克隆突变频率没有明显变化,但随后转移到作为类器官的基础亚型。当作为异种移植生长时,这些基础类器官又恢复到管腔表型,表明类器官培养条件与异种移植物环境是这种表型可塑性的原因。显然,对调节表型的因素的更好理解将导致类器官模型的改进。生长因子的修饰已经改善了肠道类器官的分泌谱系规格和肝脏类器官的肝细胞规格,在缺氧或不依赖锚定的条件下培养也可以提供肿瘤类器官相对于正常类器官的选择优势。
目前,使用类器官的高通量药物筛选大多涉及对肿瘤类器官有直接影响的药物。除非使用更复杂的共培养模型,否则在筛选阻断肿瘤间质或肿瘤免疫相互作用的药物时,单独的类器官将无法提供有用的结果。生态位因子的存在可能会进一步限制筛选中使用的小分子抑制剂的类型。例如,在常规类器官培养过程中需要BMP和TGF-β抑制剂,以防止使用药物清单上的相关激动剂。Wnt抑制剂筛选只有在Wnt产生肿瘤类器官自分泌的情况下才有可能,但它无法模拟肿瘤基质中Wnt来源的阻断。类器官培养物中增殖性干细胞的优势可能会夸大它们对靶向细胞周期的药物的反应。最后,培养条件和类器官大小已被证明会改变细胞可塑性,如PDAC和CRC类器官所示,这反过来可能会影响药物反应。因此,基于类器官药物筛选的发现需要通过临床前研究和临床试验进行广泛验证。
迄今为止,几种类器官培养方法已开始将微环境的一些成分,如基质细胞、脉管系统和免疫细胞,纳入其类器官中,使其更具生理相关性(图1和2)。胰腺肿瘤类器官与癌相关成纤维细胞共同培养表明,来自基质的外源性Wnt供应可增加Wnt依赖性PDAC细胞的致瘤潜能。此外,肿瘤类器官和自体T细胞的共同培养导致患者特异性肿瘤反应性T细胞的扩张,过继性T细胞转移的潜在临床策略。另一种方法涉及基于3D生物打印的模型,该模型包括用组织基质的关键成分(包括癌相关成纤维细胞、内皮细胞和平滑肌细胞)在3D中重建膀胱癌症类器官,创建多层“集合体”,内皮细胞能够形成支持肿瘤生长的功能性血管网络。对组装体的分析揭示了旁分泌环,由此成纤维细胞分泌的BMP诱导肿瘤中FOXA1的表达,这反过来驱动增强子重编程以赋予肿瘤亚型可塑性。与传统的膀胱肿瘤类器官相比,组装体对化疗药物的敏感性也较低。
此外,还描述了一种“血管网上的器官”模型,该模型涉及将人CRC或正常肠类器官与过表达胚胎限制性E26转化特异性(ETS)变体转录因子2(ETV2)的修饰形式的内皮细胞共同培养,从而形成可灌注血管网络。有趣的是,这种共培养模型表明,CRC类器官中与不良预后和转移相关的基因上调。最后,成功地应用ALI方法建立了28种不同癌症类型的100个ALI肿瘤器官。另一种方法是从患者肿瘤的针头活检中产生微有机球。将肿瘤在Matrigel中消化成悬浮细胞,然后与油混合,生成基于微流体的液滴,用于随后的培养和药物筛选,使其能够在14天内读出。这两种模型都能够保护肿瘤微环境,包括肿瘤浸润淋巴细胞,使其在免疫肿瘤学研究中具有潜在的未来应用前景。当然,这些对现有协议的改进和适应是令人兴奋的,但对预对准环境进行建模是另一个挑战。癌前细胞和基质成分之间的相互作用无疑在肿瘤发生中发挥作用。事实上,与L2-IL-1B小鼠的中性粒细胞共培养的小鼠Barrett食管类器官以剂量依赖的方式增加增殖和类器官生长,这表明中性粒细胞对BE上皮细胞有直接刺激作用在未来,了解哪些其他方法可以用于将癌前微环境纳入类器官模型将是非常有趣的。
如果要在临床应用中使用类器官,则用于类器官培养的试剂和方案,无论是用于癌前研究还是更广泛的研究,都需要改进和标准化。目前,基质胶是类器官培养方案中使用最广泛的支架,但它是动物来源的,定义不清,因批次而异,并存在免疫原转移的风险。所有这些限制都阻碍了它在临床应用中的应用。也许低百分比基质条件下的悬浮培养技术或下一代设计基质的使用将解决这个问题,并扩大类器官在临床环境中的适用性。重要的是,类器官线仍然大多是手动生成的,每个实验室都使用自己的修改方案。最终,类器官衍生/增殖方案必须标准化和自动化,以提高再现性和可扩展性。
文章来源:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(23)00182-0
版权说明:如非注明,本站文章均为 文译生物-专业的生物医学科研服务专家 原创,转载请注明出处和附带本文链接。